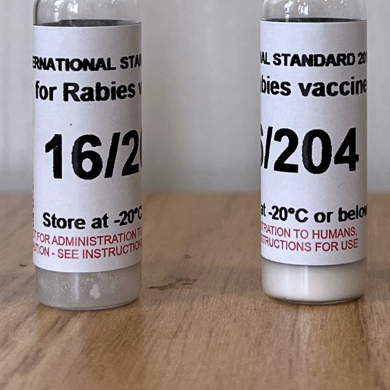
| 名称 | Rabies Vaccine/狂犬病疫苗国际标准品 |
| 货号 | 16/204 NIBSC16/204 |
| 类别 | 狂犬病疫苗 |
| 关键字 | NIH小鼠效力ELISA SRD 3Rs 3R皮特曼-摩尔 |
| 级别 | 国际标准 |
| 证书类型 | 每位客户每年仅5次 |
| 最小订购量 | 1 |
16/204 单位 分配给该材料的单位如下:用于NIH小鼠效力测试时,单位为8.9 IU/安瓿(即按照1mL蒸馏水的指示重新配制时为8.9 IU/mL)。用于糖蛋白含量的ELISA,单位为2.5IU/安瓿。(即当内容物按照0.5mL蒸馏水中的指示重新配制时为5.0IU/mL)。用于SRD的糖蛋白含量,单位为2.9 IU/安瓿。(即当内容物按照0.5mL蒸馏水中的指示重新配制时为5.8IU/mL)。
NIBSC16/204生物材料原产国:法国。每个安瓿含有0.5毫升商业狂犬病疫苗散装品的冻干残留物,该疫苗散装品含有在Vero细胞中生长的灭活皮特曼-摩尔病毒。将制剂装入DIN安瓿中,并按照记录的程序在NIBSC冷冻干燥。该填料为0.5g填料重量,平均干重为0.5238g,变异系数(%CV)为0.3255%;n=372。在12个样品上测量的残留水分平均值为0.4%,%CV为20.5%。在12个安瓿中测量的氧气顶部空间的平均值为0.13%,%CV为81.37%。不确定性:拟议的单位不具有与其校准相关的不确定性。因此,唯一的不确定性来自安瓿内容物干填充重量的可变性。
储存安瓿在使用前应储存在-20°C或以下。请注意:由于冻干材料的固有稳定性,NIBSC可能会在环境温度下运输这些材料。
狂犬病疫苗国际标准品稳定性 参考材料存放在NIBSC的有保证的温度控制储存设施内,应按照标签上的指示在收到后进行储存。世界卫生组织的政策是不对其国际参考资料指定有效期。在撤销或修改之前,它们在指定的效力和状态下仍然有效。冻干产品的加速热降解评估表明,候选的第七代IS狂犬病疫苗(NIBSC 16/204)在-20°C或更低的温度下长期储存是稳定的,在-20°C下储存时,预计每年会损失0.002%的效力。材料可以在环境温度下运输。尚未对再生材料进行稳定性研究。NIBSC遵循世界卫生组织关于其参考材料的政策。